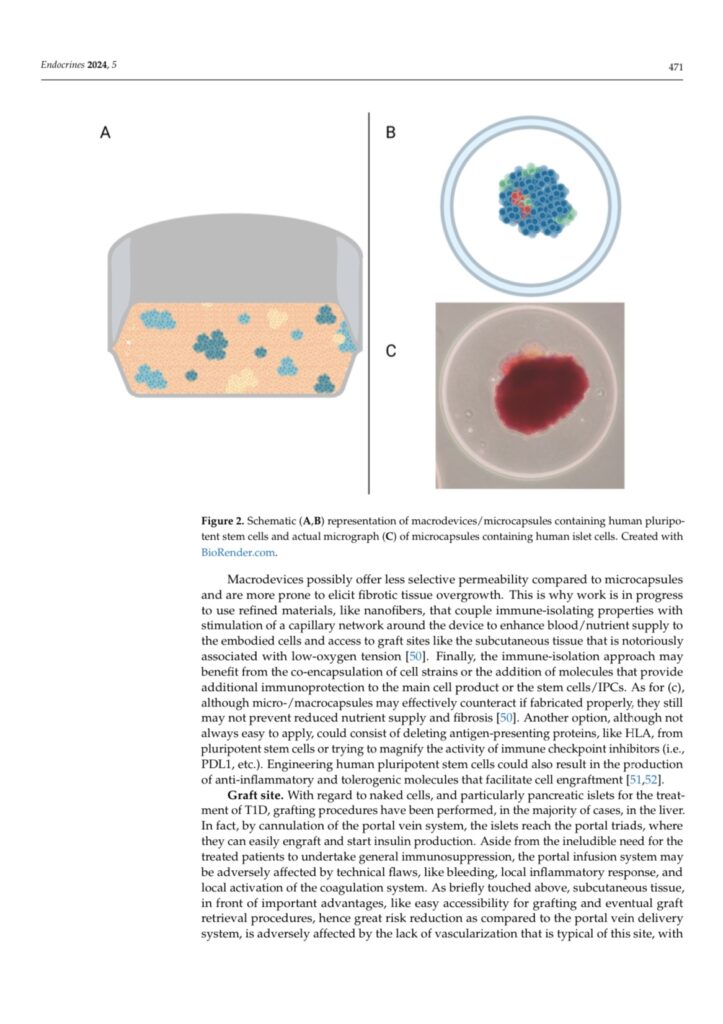
Human Stem Cell Therapy for the Cure of Type 1 Diabetes Mellitus (T1D): A Hurdle Course between Lights and Shadows
COMMENTARY
Il nostro lavoro, appena pubblicato su Endocrines, si propone di fare il punto aggiornato, sulla base della ricerca internazionale in corso, su un argomento particolarmente complesso quanto promettente: l’impiego delle cellule staminali umane per la terapia cellulare e molecolare del diabete mellito di tipo 1 (T1D).
L’idea di poter impiegare cellule staminali pluri-/multipotenti e differenziarle in cellule Beta, in grado di produrre insulina è di per sè affascinante. In effetti, i limiti finora incontrati dai trapianti di insule pancreatiche contenenti le cellule Beta estratte dal pancreas di donatori d’organo umani nei pazienti con T1D, sono consistiti essenzialmente nel limitato numero di donatori (rispetto alla quantità di insule pancreatiche necessaria a soddisfare le richieste dei potenziali beneficiari del trattamento) e nella inderogabile necessità di sottoporre i pazienti trapiantati ad una terapia immunosoppressiva generalizzata “life time”. Le cellule staminali, per la loro disponibilità di fatto illimitata e per il fatto di prestarsi a tecniche di ingegneria molecolare, potrebbero risolvere il problema dell’approvvigionamento tessutale. Questo nuovo campo di ricerca prevede comunque alcuni paletti, di qui la presenza nel titolo del lavoro della frase “luci ed ombre”. In particolare, la sorgente più efficiente di staminali pluripotenti, da inserire poi nei protocolli di differenziazione, sarebbe quella embrionale umana (hESC).
Allo stadio di blastocisti, dopo le prime divisioni della cellula uovo fecondata, le cellule della cosiddetta “massa cellulare interna” sono dotate di “pluripotenza” ovvero possono dare origine a tutti i 200 tipi di cellule presenti nell’organismo. Sono cellule altamente “plastiche” e di disponibilità virtualmente illimitata. Tuttavia, nella gran parte dei Paesi del mondo occidentale, l’uso di embrioni umani è proibito per evidenti problemi bioetici. Di qui l’esigenza di trovare sorgenti di approvvigionamento di cellule staminali da tessuti adulti. In tale senso la scoperta di Yamanaka (premio Nobel per la Medicina nel 2012 per tale motivo) delle cosiddette cellule staminali indotte alla pluripotenza (hiPSC) è stato un passo in avanti decisivo sulla strada dell’impiego di questa strategia ad una vasta messe di patologie umane compreso il T1D. Con il metodo Yamanaka è possibile impiegare una qualsiasi cellula adulta umana (es. un fibroblasto della pelle, un monocito del sangue ecc) ed ingegnerizzarla inserendo i geni della staminalità (es. NANOG, OCT4 ecc) in modo da farla tornare indietro ad uno stadio di pluripotenza.
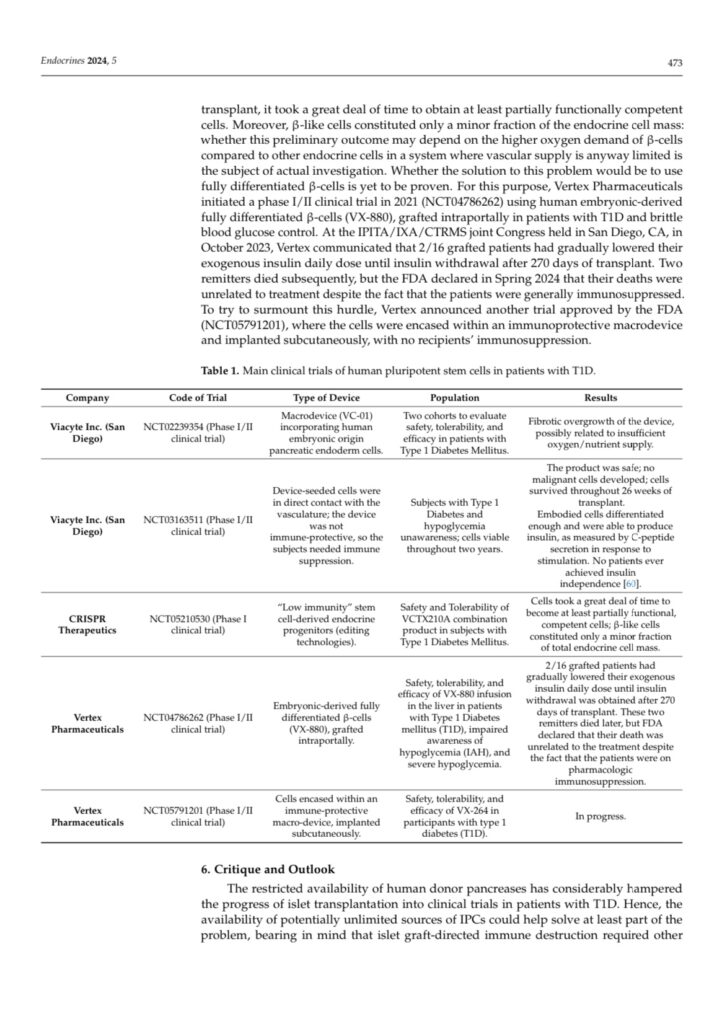
A questo punto, con protocolli di differenziazione in vitro “ad hoc”, è possibile operare la differenziazione di questi elementi potenzialmente verso cellule mature di tutti i tessuti dell’organismo. Nel nostro caso ovviamente sono in gioco le cellule Beta delle insule pancreatiche. Dopo numerosi studi in vitro e pre-clinici in modelli sperimentali animali, i primi studi clinici nell’uomo sono attualmente in corso negli USA sotto l’egida di grosse Aziende Farmaceutiche e Biotecnologiche (es. Sernova e Vertex Inc.). Lo studio Vertex ha dimostrato finora che partendo da cellule embrionali umane (che negli USA non sono soggette a vincoli etici e quindi si possono impiegare), differenziate in cellule simil-Beta in grado di produrre insulina, è stato possibile ottenere, a distanza di mesi dall’impianto di queste cellule, una discesa fino alla sospensione della terapia insulinica in 4/16 pazienti con T1D trattati. Lo studio è in corso di svolgimento ed altri pazienti mostrano una risposta al trapianto. I limiti attuali di questo studio pilota al momento evidenziabili sono due: 1) necessità di sottoporre comunque i soggetti trattati a terapia immunosoppressiva per evitare il rigetto immunitario delle cellule staminali impiantate; 2) lunghezza dei tempi di risposta funzionale rispetto al giorno di impianto (nel primo caso 270 giorni). A questo si debbono aggiungere i costi di produzione, considerato che la Vertex per allestire questo studio pilota ha speso 1 miliardo di dollari USA. Lo stesso accadrebbe se si impiegassero cellule staminali derivate da cellule adulte indotte alla pluripotenza secondo Yamanaka, perché i costi per la differenziazione di queste staminali sono davvero esorbitanti e quindi non alla portata della gran parte dei Centri che si occupano di questa ricerca. Con queste cellule è pertanto necessaria l’adozione di tecnologie immuno-molecolari per renderle bio-invisibili al sistema immunitario del ricevente, o in alternativa, per lo stesso scopo tecniche di microincapsulamento, onde evitare l’immunosoppressione farmacologica dei pazienti che sempre si accompagna ad effetti avversi a carico di diversi organi ed apparati.
Una opzione alternativa convincente all’uso di ESC o hiPSCpotrebbe essere costituita dal ricorso a cellule staminali mesenchimali adulte umane (hMSC) che si possono estrarre da numerose sorgenti tessutali (tessuto adiposo, midollo osseo, gel di Wharton del cordone ombelicale post-partum ecc). Infatti tali cellule anzitutto si possono impiegare in assenza di vincoli etici perché adulte. Inoltre le hMSC sono dotate di importanti proprietà immuno-regolatorie, in grado proteggere l’impianto cellulare dalla risposta immunitaria dell’ospite. In particolare, quando estratte dal Gel di Wharton del cordone ombelicale umano, come facciamo nel nostro Laboratorio, le hMSC sono in grado, come ampiamente da noi dimostrato nell’animale da esperimento, di contrastare la risposta autoimmunitaria alla base di numerose patologie umane, incluso il T1D. Pertanto se somministrate in una fase precoce della malattia, come osservato nel topo NOD, che sviluppa un T1D del tutto simile a quello umano, è possibile prevenire l’autodistruzione delle cellule Beta su vasta scala ed evitare l’impiego dell’insulina. Tradotto al paziente con T1D questo approccio si potrebbe applicare in quei pazienti con T1D di recente insorgenza, in cui il processo distruttivo della malattia potrebbe essere arrestato, di fatto consentendo al paziente di evitare la terapia insulinica. Oltre al fatto che le stesse hMSCpossono essere transdifferenziate in cellule simil-Beta pancreatiche in grado di produrre insulina.
Quindi la frase “luci ed ombre” ben si addice ad una nuova tecnologia che apre nuovi orizzonti alla ricerca avanzata sulla terapia cellulare e molecolare del T1D e rappresenta una speranza reale per la futura gestione clinica della malattia diabetica, ma con vari ostacoli di natura tecnica e logistica che dovranno essere superati per garantire il successo di queste nuove strategie terapeutiche.